Nowego wykazu leków zagrożonych brakiem dostępności spodziewaliśmy się dopiero w styczniu. Niespodziewanie pojawił się teraz, wraz z zapowiedzią nowej listy refundacyjnej. Jako zagrożone uznano kolejne sześć leków (łącznie 422 pozycje), ale bardziej zainteresował nas proces, w jakim powstaje wykaz. Dodane ostatnio leki nasuwają wątpliwości, czy oficjalnie komunikowane kryteria odpowiadają rzeczywistości. Nasza analiza je potwierdziła.
pozostali autorzy: mgr farm. Katarzyna Domagała.
Powtarzana przez media formuła towarzysząca wykazowi leków zagrożonych brakiem dostępności wskazuje na konkretne kryteria włączenia na listę. Mają tam trafiać leki, których brak zgłosiło przynajmniej 5% aptek w którymś z województw. Jeszcze w piątek do tej wizji powstawania listy nawiązywał też minister zdrowia Łukasz Szumowski na konferencji prasowej.
Tymczasem, jak się okazuje, niektóre preparaty wpisane teraz do wykazu w praktyce nie były do tej pory zauważalne w obrocie - ich kody kreskowe nie pojawiły się w żadnej ze zintegrowanych z GdziePoLek około 1200 aptek, a producenci komunikują je jako nowość.
Raportowanie ich braków przez apteki, tak aby spełnione było kryterium 5% aptek w województwie wydało nam się tym samym mało prawdopodobne. Zainteresowało nas więc, w jaki sposób znalazły się na liście?
Raport z kontroli NIK sprzed dwóch lat wskazuje, że już w 2016 r. znaczna część listy (około 28% z 218 pozycji wówczas) zostały uwzględniona mimo niespełniania kryterium 5% zgłoszeń braków. Najczęstszym powodem były prośby koncernów farmaceutycznych.
Jeśli rzeczywiście znaczna część listy nie spełnia komunikowanych oficjalnie kryteriów, to oprócz aspektu wprowadzania w błąd opinii publicznej, zwróciliśmy uwagę na zgodność praktyki z prawem krajowym oraz UE.
Po zakończeniu analizy otrzymaliśmy potwierdzenie od ministerstwa, że rzeczywiście kryterium 5% aptek nie jest jedynym, które decyduje o włączeniu na listę (niżej: odpowiedź wiceministra Macieja Miłkowskiego ).
Jak Ministerstwo przedstawia kryteria ujęcia w wykazie
Publikacja aktualnego obwieszczenia 12 grudnia okazała się być przedświąteczną niespodzianką. Zgodnie z zapisami ustawy Prawo farmaceutyczne, obwieszczenie powinno być publikowane "co najmniej raz na dwa miesiące". Do tej pory Ministerstwo raczej wyczerpywało ten termin, publikując w tym roku wykaz leków zagrożonych brakiem dostępności w odstępach trwających od 52 do nawet 70 dni. Od publikacji poprzedniej listy (8 listopada), minął natomiast nieco ponad miesiąc (34 dni).
Jak podkreślają urzędnicy resoru zdrowia, wykaz leków zagrożonych brakiem dostępności nie jest listą “brakujących leków”. Jest to powód, dla którego GdziePoLek przygotowuje własny, niezależny raport, gdzie oprócz spadku dostępności, brane są pod uwagę także inne kryteria, w tym dostępność zamienników. Lista opublikowana 12. grudnia liczy 50 pozycji (więcej: Leki, które zniknęły z aptek: grudzień 2019).
Funkcją wykazu leków zagrożonych brakiem dostępności jest natomiast ograniczenie wywozu tych produktów leczniczych, w przypadku których zgłoszone zostały problemy z ich pozyskaniem dla pacjentów.
Wykaz jest jednak jedynym kojarzonym z problemem dostępności leków dokumentem, który publikuje ministerstwo. Odbija się więc szerokim echem w mediach, a te powtarzają identyczny opis metodyki, który można odnaleźć w depeszach PAP:
"Na liście umieszczane są te leki, których brakuje w 5 proc. aptek w danym województwie. Informacje o brakach zgłaszają wojewódzcy inspektorzy farmaceutyczni głównemu inspektorowi, a ten informuje o tym ministra zdrowia. Minister o brakach leków informuje w obwieszczeniu. Lista jest jednym z narzędzi, które ma ograniczyć problem niekontrolowanego wywozu leków z Polski."
Przykłady nagłówków mediów informujących o wykazie leków zagrożonych brakiem dostępności

Źródło: strony internetowe mediów
Jak wynika z relacji dziennikarki PAP Katarzyny Lechowicz-Dyl, na ostatniej konferencji prasowej w piątek o tej metodyce mówił też minister zdrowia Łukasz Szumowski:
"To nie jest lista leków, których nie ma, ani to nie jest lista leków, których brakuje. To jest lista leków, o których wiemy, że może pojawić się chęć ich wywozu z kraju. To tzw. lista antywywozowa, tych leków zgodnie z prawem nie można wywozić. (...) Oznacza to, że w 95 proc. aptek leki są dostępne, ale zapalamy czerwone światło, żeby z wyprzedzeniem reagować na potencjalne problemy."
Nie możemy potwierdzić oryginalnej wypowiedzi z konferencji, ale podobną historię powstawania listy minister przedstawił w wywiadzie dla Polsat News, który dostępny jest online.
Minister Zdrowia Łukasz Szumowski tłumaczy dla Polsat News, jak powstaje i czym jest lista leków zagrożonych

Źródło: Polsat News z 14.12.2019, fragment około 7:25
Pomijając kwestię, jak rzeczywiście powstaje lista, w przedstawieniu metodyki można dostrzec brak logiki lub skrót myślowy: fakt zgłoszenia braku leku przez minimum 5% aptek oczywiście nie oznacza automatycznie, że w 95% aptek lek jest dostępny.
Równie dobrze brak może występować w 100% aptek, tak, jak to jest na przykład w przypadku wpisanych na ministerialną listę leków Jodid 100 (chociaż równie odczuwalny dla pacjentów jest brak nieuwzględnionej przez ministerstwo dawki Jodid 200 µg), Novothyral, Novothyral 75, BCG-Medac czy Gardasil.
Jakie leki zostały dodane do wykazu?
Do listy dodano sześć preparatów. Jest wśród nich insulina, preparat dla astmatyków i kilka wersji plastrów z hormonami dla kobiet w okresie menopauzy.
Sześć pozycji, o które wydłużył się wykaz leków zagrożonych brakiem dostępności w grudniu 2019
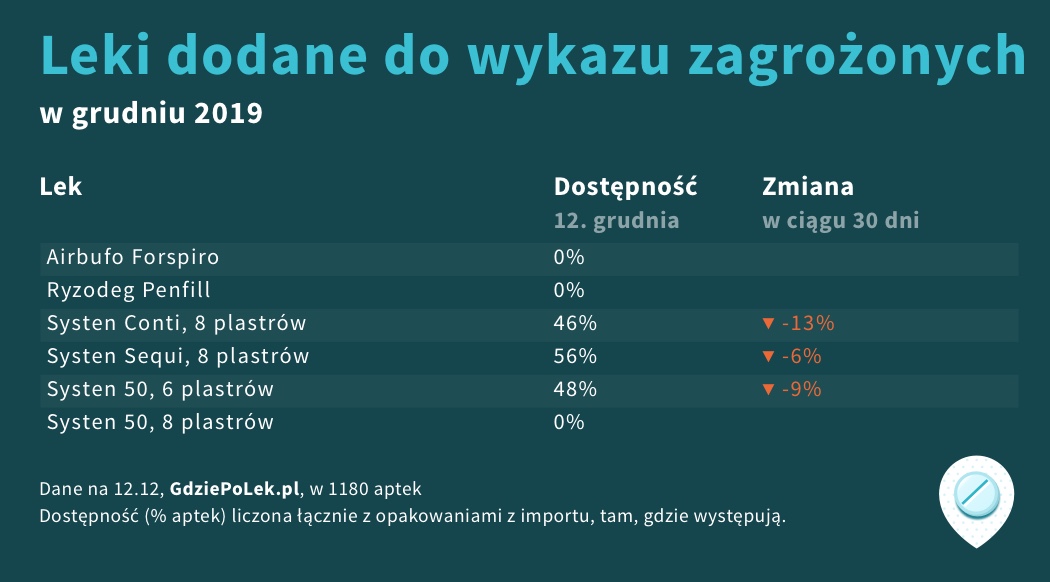
Źródło: GdziePoLek.pl
Systen 50 w postaci systemu transdermalnego o szybkości uwalniania 50 mcg w ciągu doby to lek zawierający estradiol, łagodzący objawy menopauzy i zapobiegający utracie kości u kobiet w okresie klimakterium. Do wykazu dołączono opakowaniu po 6 i 8 plastrów. Dla opakowania mniejszego zaobserwowaliśmy w ostatnim czasie spadek dostępności z 73% na 48% w ciągu ostatnich 3 miesięcy. Opakowanie po 8 plastrów nie było w tym czasie w sprzedaży.
Systen Conti to wersja plastra transdermalnego, który oprócz estradiolu zawiera noretysteron. Lek stosowany jest w hormonalnej terapii zastępczej. Według statystyk GdziePoLek dostępność tego leku spadła w ostatnim kwartale z 83% na 46%.
Systen Sequi to wersja preparatu, która w jednym opakowaniu (8 plastrów) zawiera 4 plastry Systen 50 i 4 plastry Systen Conti. Wskazania to HTZ w leczeniu objawów niedoboru estrogenów związanych z menopauzą. Ilość aptek zintegrowanych z GdziePoLek deklarujących posiadanie tego preparatu zmniejszyła się w ciągu ostatnich 90 dni z 73% na 56%.
Naszą uwagę zwróciły jednak produkty Airbufo Forspiro i Ryzodeg.
Apteki miałyby zgłaszać braki leków, których nie ma jeszcze w obrocie?
Nasze dane nie wykazywały śladów faktycznego wprowadzenia tych leków do aptek, problemów z dostępnością nie zgłaszali także pacjenci. Nie znaczy to, że nie mogły być formalnie dostępne, na przykład w tak małej liczbie aptek, że nie byłyby reprezentowane w naszej próbie około 1200 placówek. Zastanowiło nas więc, z jakiego powodu znacząca liczba aptek miałyby zgłaszać ich braki.
Airbufo Forspiro jest lekiem w formule proszku do inhalacji w dzielonych dawkach zawierających połączenie 160 mcg budezonidu z 4,5 mcg formoterolu i ma zastosowanie u chorych na astmę i przewlekłą obturacyjną chorobę płuc. Pozwolenie na dopuszczenie do obrotu Prezes URPL wydał w sierpniu 2018 roku.
Jak dowiedzieliśmy się od podmiotu odpowiedzialnego jest to "nowość", którą "większość hurtowni ma już na swoich stanach". Od stycznia ma zostać objęty refundacją. Na liście leków zagrożonych brakiem dostępności są już odpowiedniki tego produktu – preparaty Bufomix Easyhaler, DuoResp Spiromax oraz Symbicort Turbuhaler. Czy w tej sytuacji nieobjęcie Airbufo Forspiro monitorowaniem mogłoby stwarzać groźny precedens?
Konferencja ministerstwa, na której zapowiedziano nowości na liście refundacyjnej, rozpoczęła się w piątek 13. grudnia o godzinie 12:00. O 13:34 tego dnia odnotowaliśmy pierwsze wejścia na stan Airbufo, którego wcześniej nie widzieliśmy w naszych aptekach.
Ryzodeg Penfill to insulina będąca połączeniem, w skład którego wchodzi insulina bazalna (długo działająca) degludec i szybko działająca insulina posiłkowa aspart, w stosunku 70/30. Ryzodeg został dopuszczony do obrotu w styczniu 2013 roku przez Komisję Europejską w ramach procedury centralnej.
W Polsce insulina ma być refundowana od 1 stycznia. Jak podkreślił wiceminister zdrowia, Maciej Miłkowski, refundacja tej opcji terapeutycznej nie byłaby możliwa „bez szczególnych warunków dla Polski ” zatwierdzonych przez prezesa Novo Nordisk Larsa Fruergaarda Jørgensena. Można przypuszczać, ze wynegocjowana cena jest wystarczająco niska, aby powodować sprzyjający wywozowi gradient. Sama formuła preparatu mogłaby być także czynnikiem wpływającym na popyt i opłacalność ewentualnego wywozu. Ryzodeg ma prosty schemat dawkowania, co ma przyczyniać się do zwiększenia komfortu i bezpieczeństwa pacjenta, umożliwiając mniejszą liczbę wstrzyknięć i ograniczając zużycie wyrobów jednorazowych. Stosowanie leku wiąże się z niskim ryzykiem hipoglikemii.
Według informacji od podmiotu odpowiedzialnego, "produkt jest dostępny na terenie Polski i hurtownie mogą go zamawiać". Jednak hurtownicy, z którymi udało nam się skontaktować nie mają założonych kart produktowych na tę insulinę. Z dalszej korespondencji wynika, że apteki mogą zamawiać lek przez email bezpośrednio u podmiotu odpowiedzialnego.
Nie jest to pierwszy przypadek, gdy na listę trafiają produkty, dla których nie jest widoczne występowanie zmian w dynamice obrotu czy dostępności.
Już w listopadzie odnotowaliśmy, że listą antywywozową objęto wszystkie refundowane (34 pozycje) paski testowe do glukometru, oraz niemal wszystkie dostępne na rynku insuliny przy braku sygnałów (na podstawie statystyk GdziePoLek), aby dostępność do tych produktów faktycznie zmieniała się (więcej: Jakich leków może zabraknąć w Polsce (listopad 2019)?). Również wówczas naszą uwagę zwrócił brak śladów podaży i popytu od długiego czasu dla niektórych z wpisanych na listę antywywozową produktów.W jakim więc trybie trafiają na listę? Odpowiedzi może podsuwać raport z kontroli NIK.
Proces tworzenia wykazu według kontroli NIK
Dwa lata temu delegatura NIK w Zielonej Górze prowadziła kontrolę związaną z dostępnością produktów leczniczych. Raport pokontrolny dostarcza szeregu ciekawych informacji, w tym dotyczących procesu raportowania braków i tworzenia z nich listy leków zagrożonych brakiem dostępności.
Jak ustalił NIK, w tamtym okresie proces ten był rozproszony, słabo wspierany przez aplikacje IT i zajmował dużo czasu zmagającym się z brakami kadrowymi inspektorom wojewódzkim.
Proces zgłaszania braków i tworzenia wykazu w czasie kontroli NIK zakończonej w 2018 r. (przed uruchomieniem ZSMOPL)
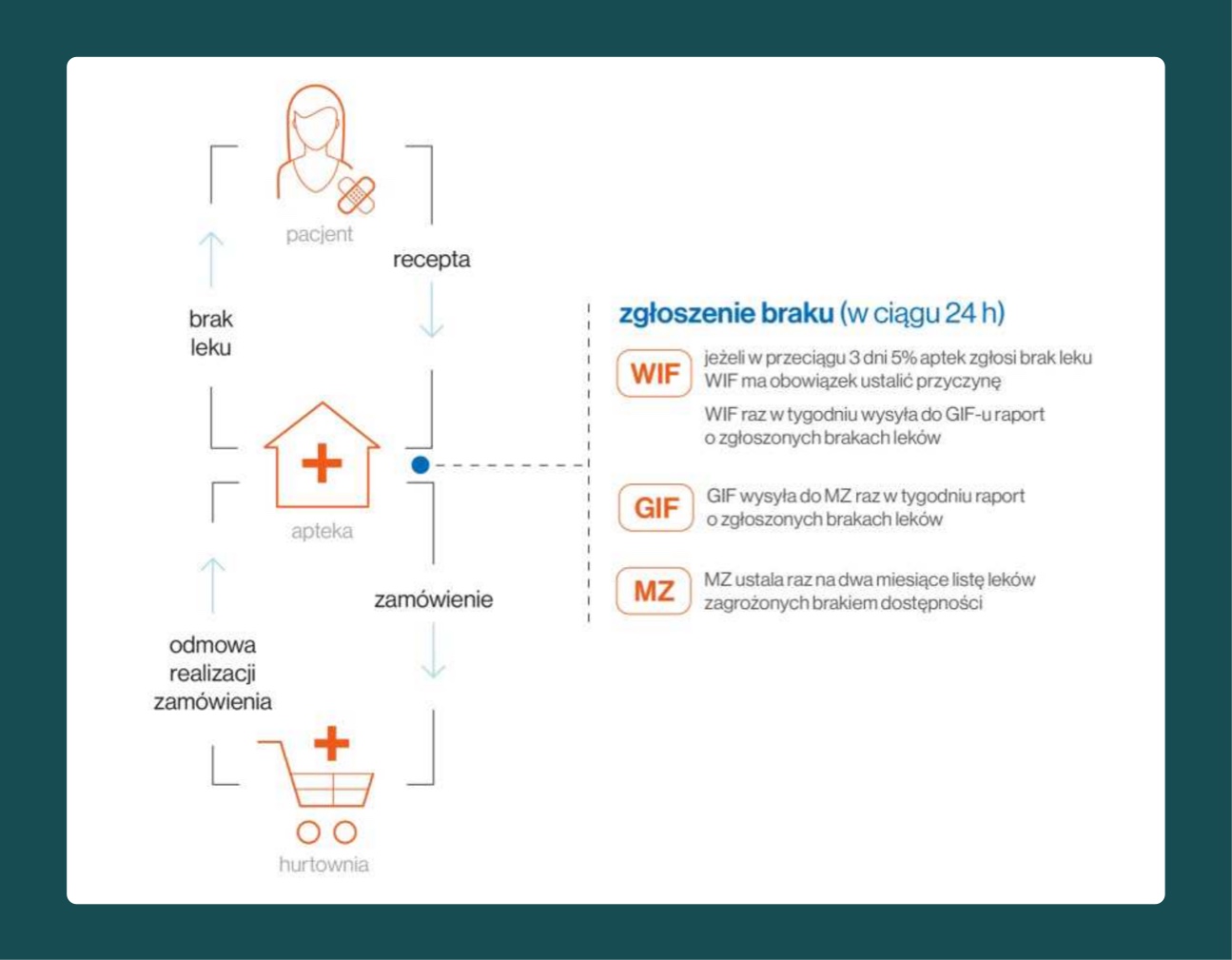
Źródło: raport po kontroli NIK "Działalność organów państwa na rzecz zapewnienia dostępności produktów leczniczych" (PDF)
Co ciekawe, w raporcie można znaleźć (jeśli śledzi się przypisy) ślady zjawiska dopisywania produktów poza oficjalnym procesem z udziałem WIF.
Według raportu w kwietniu 2016 r. spośród 218 pozycji na liście, 62 zostały dodane w związku "ze zgłoszeniami pacjentów, farmaceutów i lekarzy w przedmiocie zagrożenia dostępu (15 przypadków), prośbami podmiotów odpowiedzialnych (44 przypadki), zgłoszeniami GIF, podejrzeniami wywozu produktów (3 przypadki)" (przypis 70, strona 31).
Jak widać, już wtedy prawie 30% listy nie było kwalifikowane według komunikowanych publicznie kryteriów. Od tego czasu lista wydłużyła się z 218 do 422 pozycji obecnie.
Ciekawą informacją w raporcie, którą zaznaczylibyśmy na marginesie, jest koszt systemu ZSMOPL, dostarczonego przez Sygnity. Według NIK przygotowanie, wdrożenie i utrzymanie systemu kosztowało w latach 2015 - 2017 10,5 mln zł.
Czy arbitralne dodawanie do wykazu jest zgodne z prawem?
Prawo farmaceutyczne dostarcza szerokiej i dosyć ogólnie sformułowanej podstawy do wpisywania produktów leczniczych na listę leków zagrożonych brakiem dostępności.
Paragraf 37av, ustęp 14 Prawa Farmaceutycznego, gdzie mowa o wykazie

Źródło: Prawo Farmaceutyczne, tekst jednolity (PDF) ogłoszony 15. marca 2019 r.
Mimo to, dodawanie do wykazu produktów, których nie ma w obrocie lub które są do niego dopiero wprowadzane, wydaje się z punktu widzenia laika dość swobodnym wykorzystaniem regulacji, nie będącym reakcją na faktyczne problemy z dostępnością.
Trudno powiedzieć, jak decyzje o produktach nieobecnych czy nieaktywnych jeszcze na rynku mają “uwzględniać dynamikę obrotu”, skoro obrót dla nich nigdy nie był różny od zera i nie zmieniał się.
Jeśli intencją ustawodawcy było pozostawienie całkowitej dowolności w ocenie, jakie produkty są zagrożone brakiem dostępności, niejasne jest, po co byłoby szczegółowe definiowanie procesu raportowania braków przez apteki.
Korelacja pojawienia się kolejnego wykazu leków zagrożonych brakiem dostępności, równolegle z nową listą refundacyjną, może budzić przypuszczenia, że obejmowanie leków monitorowaniem i zakazem wywozu jest elementem negocjacji z producentami lub ich rezultatem, a nie niezależnym i obiektywnym procesem. Można w tym miejscu przypomnieć, że na "listę antywywozową" z 15. listopada trafiły flozyny (produkty Jardiance, Invokana, Forxiga), tuż po ich umieszczeniu na wykazie refundacyjnym.
Nawet gdyby jednak cała lista miała być tworzona na zasadzie uznaniowej, dlaczego miałoby to być problemem? Dlaczego profilaktycznie nie zabronić wywozu nawet całego spisu leków refundowanych?
Regulacje UE
Swobodny przepływ towarów to jeden z filarów UE. Dzięki niemu korzyści odnoszą konsumenci, którym trudniej narzucać niekorzystne warunki na którymś z rynków, gdy zawsze mają opcję zaopatrzenie się w produkt po drugiej stronie granicy.
Wprowadzanie ograniczeń jest możliwe i obszar zdrowia jest jednym z przykładów. Nie jest to jednak bezwarunkowe przyzwolenie.
Odpowiedź na interpelację Jarosława Gowina z 2014 r. sugeruje, że precyzyjne określenie procesu, w jakim leki są obejmowane ograniczeniami wywozu może mieć znaczenia dla uniknięcia zakwestionowania go na gruncie zasad UE:
Instytucja importu równoległego, pomimo że nie została objęta odrębną regulacją unijną, posiada mocne i nienaruszalne podstawy potwierdzone obszernym orzecznictwem Trybunału Sprawiedliwości Unii Europejskiej.
Warto w tym miejscu wskazać, że art. 36 traktatu oraz orzeczenia TSUE nie wykluczają bynajmniej możliwości wprowadzania ograniczeń swobody przepływu towarów w sytuacji zagrożenia życia lub zdrowia. Ograniczenia te muszą być jednak wprowadzane przez organ kompetentny, a nie przez koncerny farmaceutyczne.
Jak bowiem wypowiedział się w tym zakresie TSUE w orzeczeniu z dnia 16 września 2008 r., gdyby handel równoległy miał doprowadzić do braków w zaopatrzeniu na rynku krajowym, to właściwe do uregulowania tej kwestii są organy państwa, których problem dotyczy, a nie koncerny farmaceutyczne. Uwzględniając więc art. 36 traktatu oraz orzeczenie TSUE z 2008 r., możliwe jest wprowadzenie pewnych rozwiązań prawnych ograniczających import równoległy w sytuacjach zagrożenia życia lub zdrowia, pod warunkiem że ograniczenia te są konieczne i proporcjonalne.
Dodatkowo, jak widać, zakusy na wprowadzanie ograniczeń w przepływie leków wykazywały koncerny farmaceutyczne, jednak zostało to najwyraźniej ograniczone. Przekonanie do swoich racji organów państwowych pozostaje więc dla nich dostępną ścieżką zabezpieczenia swoich interesów.
Prezes AstraZeneca Pharma Poland Jarosław Oleszczuk wyjaśnia, jak ograniczenia przepływu leków pomagają korporacji w planowaniu produkcji
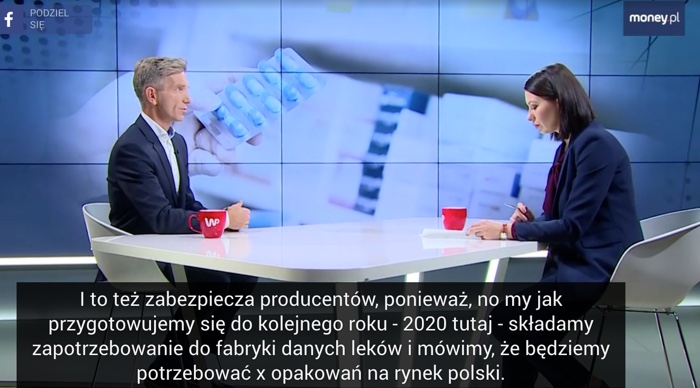
Źródło: wywiad dla money.pl z 13.12.2019
Skontaktowaliśmy się z prawnikami specjalizującymi się w sektorze farmaceutycznym, aby uzyskać ich komentarz.
Prawnicy: delikatny temat
Ekspert jednej z międzynarodowych kancelarii potwierdził, że chęć utrzymania zgodności z regulacjami UE może być ważnym aspektem dla zrozumienia komunikacji i działań administracji. Ze względu na fakt, że klientami kancelarii są firmy farmaceutyczne, a także na brak ostatnich analiz tego tematu, uznał temat za zbyt ryzykowny do wypowiadania się pod nazwiskiem.
Prawnik z mniejszej, polskiej kancelarii specjalizowanej w prawie farmaceutycznym również powiedział nam, że temat jest zbyt delikatny na komentowanie pod nazwiskiem: jak się okazuje, to, o co zabiegają klienci tej firmy, to wpisanie swoich produktów do wykazu.
Problemem z ich punktu widzenia jest więc to jak... trudno przekonać ministerstwo do uwzględnienia produktów w wykazie, mimo, że producent przedstawia dane dowodzące problemów z ich dostępnością.
Z punktu widzenia producentów (lub dokładniej ich lokalnych oddziałów) sytuacja jest niełatwa z powodu z jednej strony żądań urzędów co do zapewnienia odpowiedniej dostępności, a z drugiej strony ograniczeń w próbie zatrzymania wywozu, na przykład protestów aptek w przypadku reglamentacji. Z tego powodu pozytywnie oceniają kolejne środki zapobiegania wywozowi, które są wprowadzane oprócz listy leków zagrożonych.
Minimalny standard: transparentna komunikacja metodyki
Chęć działania prewencyjnego w interesie polskich pacjentów jest zrozumiała, jednak zasada obejmowania leków dodatkowym monitorowaniem powinna być transparentna. Jeśli część listy powstaje w sposób uznaniowy, opinia publiczna nie powinna być wprowadzana w błąd co do metodyki sporządzania tego wykazu, orbitującej wokół "zasady 5%".
Po zakończeniu tekstu przesłaliśmy go do ministerstwa z prośbą o komentarz.
Ministerstwo: tak, 5% to nie jedyne kryterium
"Faktycznie 5% nie jest jedynym kryterium wpisania na listę. Są rożne powody" odpisał wiceminister Maciej Miłkowski.
Jednym ze scenariuszy jest widoczne w naszej analizie kwalifikowanie na listę wszystkich podobnych produktów. Jak pisze minister, przykładem są insuliny, z których dostępnością był problem. W związku z tym na listę wprowadzono wszystkie insuliny, nawet te, które dopiero się pojawiają. Podobnie tworzone są inne grupy listy leków zagrożonych wywozem. Było tak również z lekami przeciwkrzepliwymi.
Inny scenariusz to dodanie do listy nawet przy braku informacji o niedoborach.
"Nawet jeśli nie ma żadnych informacji o brakach to czasami wiemy, że problemy z brakami mogą być, gdyż znamy szacunkowe obroty i wiemy jakie są plany dostaw - wówczas wiemy, że z uwzględnieniem wywozu będziemy mieli problem na polskim rynku."
Wnioskodawcą dla wprowadzenia produktu na listę, zgodnie z tym, na co wskazywały rozmowy z prawnikami, mogą być też firmy farmaceutyczne.
"Oczywiście również współpracujemy z firmami farmaceutycznymi - mają prawo również zgłaszać takie propozycje wraz z uzasadnieniem - i za każdym razem sytuacja jest analizowana indywidualnie."
Podsumowując całość procesu: "podstawą dla listy jest GIF, ale również sytuacja na rynku całego asortymentu danych leków, informacja ze ZSMOPLa dotycząca dostępnych ilości produktów na różnych etapach łańcucha dostaw oraz planowanych dostaw i faktycznej sprzedaży w obrocie detalicznym i szpitalnym."
Ostatnim z naszych pytań było powiązanie pomiędzy negocjacjami refundacji a ewentualnym wpisem na listę. "Istotnym elementem mogą być różnice w cenach pomiędzy państwami - producent zobowiązuje dostarczyć się określone ilości do Polski - my negocjujemy ilości dla polskich pacjentów, a nie dla hurtowni zagranicznych - dla pacjentów w innych państwach."
Zdjęcie tytułowe
Harris & Ewing, Office With Typewriters, 1922. Biblioteka Kongresu.
Prawa autorskie
Dozwolone kopiowanie ilustracji autorstwa GdziePoLek na własną stronę, pod warunkiem umieszczenia aktywnego linku do źródła. Kopiowanie całości lub większości tekstu nie jest dozwolone.
